|
iiiiiiiii | Décembre 2017 |
| iiiiiiiii |  |
|
 |
||
– Dans le numéro 232 de Spectra Biologie –
Consultez gratuitement nos vidéos et interviews !
Témoignages-client (sponsorisés)
 |
Innovations |
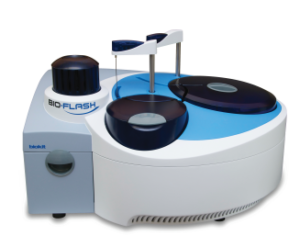
Dosage de l’HMGCR par chimiluminescence
L’anticorps anti 3-hydroxy-3-méthylglutaryl-conenzyme A réductase (HMGCR) a été décrit il y a quelques années dans les myopathies nécrosantes auto-immunes et est spécifique de cette pathologie. Dans 75 % des cas, il est observé chez des patients ayant pris des statines. Cet anticorps est corrélé à l’activité de la maladie. La présence de cet anticorps anti HMGCR aide à différencier les myopathies nécrosantes auto-immunes, des myopathies.
Son dosage est maintenant possible sur le Bio-Flash, automate de chimiluminescence en accès continu et aléatoire, et dédié à l’auto-immunité. Outre la grande facilité de mise en œuvre, il permet une quantification de cet anticorps en 30 minutes, très utile dans le dépistage et le suivi des patients. Avec la cartouche de 50 tests qui reste à bord de l’automate 24h/24, la fréquence d’étalonnage limitée au changement de lot de réactifs, l’utilisation du Bio-Flash est particulièrement adaptée au coup par coup, permettant ainsi un rendu de résultat rapide. Les résultats sont exprimés en Chimiluminescent Unit (CU). Le seuil de positivité au 99e percentile a été établi à 20 CU. Le vaste domaine de mesure, de 1,5 CU à 550 CU limite au maximum les redosages. Avec un CV de répétabilité inférieur à 5 %, la méthode de dosage permet ainsi une quantification très fiable de cet autoanticorps.
Surveillance rapide de l’hémostase
Dans les services, tels que les blocs de chirurgie cardiovasculaire, il est essentiel d’obtenir des informations rapides sur la formation du caillot de fibrine et une mesure précise de l’action de l’héparine pour des concentrations de 0,1 jusqu’à 6 IU/mL. L’Hemochron® Signature Elite proposé par Werfen est, sur le marché, l’appareil délocalisé qui rend les résultats les plus rapides sur la formation du caillot de fibrine (4–5 min). Cette technologie de mesure de l’ACT+ optimise la mise en œuvre de la CEC (Circulation Extra-Corporelle), le contrôle de la concentration d’héparine pendant la durée de la procédure ainsi que la neutralisation de l’héparine en fin de CEC.
– ACT+ non affecté par l’hémodilution et l’hypothermie (situation habituelle en chirurgie cardiaque)
– Reflet en temps réel de la formation du caillot de fibrine
– Cuvette ACT-LR pour les contextes cliniques à faibles concentrations d’héparine (0,1 à 2,5 IU/mL) (Cathétérisme, Dialyse, ECMO).
L’Hemochron® Signature Elite est compatible avec les exigences de l’accréditation : contrôles qualité électroniques intégrés, et automatiques, validation des lots de contrôles qualité et des cuvettes, blocage des lots de contrôles qualité et cuvettes non validées et/ou périmées, utilisation de l’appareil possible uniquement pour les opérateurs enregistrés et validés, sécurité assurée grâce au lecteur de code-barres, connectable aux principaux systèmes d’information des laboratoires.
Parc informatique : de nouveaux outils d’analyse
La société d’infogérance des parcs informatiques 5.i LAB a été co-fondée avec un biologiste pour adresser spécifiquement les problématiques de support informatique et de maîtrise du système informatique des laboratoires de biologie médicale. Elle a été créée en 2008, alors que le secteur des LBM allait devoir accélérer sa concentration et sa démarche d’accréditation qualité et aujourd’hui, elle assure le support HelpDesk pour plus de 200 laboratoires en France. Dans ce contexte, 5.i LAB apporte une offre de services garantissant proximité et efficacité pour la résolution des incidents quotidiens et pour le déploiement des nouvelles solutions informatiques.
Dans le but de maîtriser au mieux l’optimisation du parc des matériels informatiques, 5.i LAB a récemment mis en service 2 nouvelles fonctionnalités :
– le contrôle d’inventaire sur site qui permet d’obtenir très rapidement un inventaire précis des matériels en service sur chaque site. Le résultat de l’inventaire est alors disponible en ligne sur l’outil de gestion de parc ou sur documents électroniques.
– un outil de BI qui permet d’avoir accès à un ensemble très complet d’analyses et de graphiques portant sur toutes les actions de support (incidents, demandes, interventions sur site).
Enfin, pour s’assurer de la satisfaction des utilisateurs de ses services, 5.i LAB propose de réaliser des enquêtes de satisfaction sur mesure, collectées sur smartphones ou sur pc, avec mise à disposition des résultats.
Solution numérique de gestion des EBMD et de leurs habilitations
L’adoption d’une solution numérique permettant la mise en place de la stratégie d’Examens de Biologie Médicale Délocalisée (EBMD) est aujourd’hui nécessaire dans le cadre de la norme ISO 22870. GEMweb® Plus 500, Custom Connectivity, est un outil ouvert intuitif pour la gestion des informations entre les analyseurs de biologie délocalisée et l’informatique centrale du laboratoire ou de l’hôpital. Il permet au laboratoire d’une part d’avoir une visibilité constante sur les analyseurs d’EBMD (nombre de tests, état de maintenance et des contrôles qualité, sélection des paramètres à tester), d’autre part de gérer les opérateurs (droit d’accès, mot de passe) et enfin de gérer de façon automatique les habilitations et leur renouvellement. Le module d’habilitation exclusif du GEMweb® Plus 500 permet aux biologistes de créer leurs propres examens en fonction du niveau de connaissance requis pour un groupe d’opérateurs. Le suivi des habilitations est parfaitement fluide : chaque opérateur est prévenu d’avance pour le renouvellement de son habilitation, l’analyseur de gaz de sang Werfen (GEM® Premier™ 4000, GEM® Premier™ 5000) peut empêcher un opérateur de passer un échantillon dans le cas où son habilitation n’est pas renouvelée, l’opérateur sera ensuite réhabilité automatiquement après réussite de l’examen. En outre, la génération de rapports détaillés permet une traçabilité complète avec un suivi des résultats patients, des échantillons et de l’activité par opérateur ou par analyseur.
Nouveau portail pour les patients et les professionnels de santé
Netika a présenté son nouveau portail à destination des patients et des professionnels de santé tant du secteur public que privé. Parfaitement intégré à la famille de logiciels KALI, ce nouveau module devient le principal média de communication du laboratoire. Réalisé en responsive design, il est compatible avec tous types de support (smartphone, phablette, tablette ou PC) et ne nécessite le téléchargement d’aucune application. Chaque patient pourra créer et gérer son compte en toute autonomie via un accès sécurisé et pourra accéder, entre autres, à ses résultats, ses ordonnances renouvelables, ou encore à ses comptes rendus signés électroniquement. Des fonctionnalités de paiement en ligne et de prise de rendez-vous viennent enrichir ce nouveau portail afin de simplifier la relation avec les patients. Pour les professionnels de santé, qu’ils soient médecins libéraux, infirmières ou établissements de soins, les avantages sont majeurs. Il sera notamment possible de visualiser l’historique des résultats sous la forme d’un tableau ou d’une représentation graphique, d’accéder au manuel de prélèvement, de consulter les ordonnances…
Pour le laboratoire, la traçabilité et le suivi en temps réel de l’activité du portail et la visualisation de l’état de consultation des informations par les patients à travers KaliSil est un élément fondamental. La personnalisation d’un portail dédié permet une différenciation notable et l’autonomie du patient dans la gestion de son compte restera un élément de satisfaction partagé.
Chaîne robotique dédiée à l’hémostase
Werfen avec sa marque Instrumentation Laboratory poursuit son innovation en hémostase en adéquation avec les besoins du marché français : standardisation, automatisation et accréditation. Fort du succès de sa famille d’instruments ACL TOP série 50, Werfen qui est aujourd’hui leader dans le management des interférences pré-analytiques, complété par sa gamme de réactifs HemosIL prêts à l’emploi, lance une chaîne robotique dédiée à l’hémostase: HemoCell. Cette chaîne robotique se propose de standardiser la paillasse d’hémostase en automatisant les différentes étapes pré-analytiques, analytiques et post-analytiques (tri des tubes, centrifugation, convoyage, analyse, validation des résultats…). Composée d’éléments modulaires, cette chaîne est configurable à façon, de manière à s’adapter aux différentes contraintes des plateaux techniques, qu’ils soient privés ou hospitaliers. Le Data Management System (DMS) HemoHub spécialisé en hémostase permet le contrôle de cet ensemble. La combinaison de la gestion centralisée des contrôles de qualité, des règles de routage du management des interférences pré-analytiques des ACL TOP série 50 (HIL : Hémolyse Ictère, Lipémie mais aussi remplissage du tube et détection de µ-caillots) permet d’obtenir des temps de rendus de résultats (TAT) réduits et une optimisation des temps opérateurs.
 |
Actualités |
Insuffisance cardiaque : Ortho veut mesurer la congestion résiduelle
Ortho Clinical Diagnostics (Ortho), l’un des leaders mondiaux du diagnostic in vitro, et sphingotec GmbH se sont associés à long terme via un accord stratégique mondial concernant l’adrénomédulline (sphingotest® bio-ADM®). Ce marqueur de la fonction endothéliale biologiquement actif permet de mesurer le taux de récupération des patients après une insuffisance cardiaque aiguë, et fournit ainsi des informations essentielles aux médecins prenant les décisions thérapeutiques. Cet accord permet à Ortho d’utiliser l’immunoessai sphingotest® bio-ADM® avec ses systèmes automatisés VITROS® Immunodiagnostics et Integrated Systems pour les laboratoires cliniques de petite, moyenne et grande envergure.
La congestion en cas d’insuffisance cardiaque aiguë, principalement causée par un dysfonctionnement endothélial, constitue un grave problème médical et la principale cause de réhospitalisation des patients concernés. Outre l’utilisation courante des peptides natriurétiques dans le diagnostic de l’insuffisance cardiaque, l’identification précise d’une congestion résiduelle pendant et après le traitement demeure un besoin médical non satisfait en matière de détermination de l’adéquation d’un traitement contre l’insuffisance cardiaque aiguë. La congestion cardiaque résiduelle à la sortie de l’hôpital est particulièrement associée à un risque élevé de réhospitalisation et de mortalité, ce qui appuie la nécessité d’évaluer et de surveiller l’adéquation du traitement décongestionnant tout au long de l’hospitalisation. Plusieurs études cliniques ont évalué la capacité de bio-ADM® à établir un diagnostic précis de la congestion résiduelle, à surveiller l’efficacité du traitement et à identifier les patients en mesure de quitter l’hôpital.
L’immunoessai Sphingotest® bio-ADM® marqué CE de sphingotec GmbH mesure la forme bioactive de l’adrénomédulline, une hormone peptidique essentielle au maintien de la fonction de la barrière endothéliale.
« La collaboration avec Ortho Clinical Diagnostics nous permettra de fournir notre essai standardisé sphingotest® bio-ADM® à des laboratoires à travers le monde pour les aider à diagnostiquer efficacement la congestion résiduelle chez les patients souffrant d’insuffisance cardiaque, et ce suffisamment tôt pour mettre en place une intervention efficace, voire pour modifier leur traitement », a déclaré Andreas Bergmann, fondateur et directeur général de Sphingotec GmbH.
Sphingotec GmbH développe également des biomarqueurs innovants pour le diagnostic, la prévision et le suivi d’autres pathologies aiguës, telles que l’insuffisance rénale aiguë et le choc circulatoire. Sphingotec développe par ailleurs des biomarqueurs pour la prédiction des facteurs de risque pour la santé comme l’obésité, les maladies cardiovasculaires et le cancer du sein, afin de soutenir les stratégies de prévention.
8e test de monitoring aux Etats-Unis pour Theradiag
Theradiag, société spécialisée dans le diagnostic in vitro et le théranostic, a annoncé que son partenaire Miraca Life Sciences commercialise dorénavant aux États-Unis un huitième test de monitoring de la gamme Lisa Tracker® sous le nom InformTxTM. InformTxTM est la gamme de monitoring commercialisée aux États-Unis par Miraca dans le cadre de l’accord de licence de technologie de la gamme Lisa Tracker® de Theradiag.
Le kit de monitoring de Renflexis® (Infliximab-abda), en cours de validation, complètera l’offre. Depuis le lancement de cette offre par Miraca Life Sciences, le nombre de tests de monitoring désormais disponibles sur le marché américain a été étendu à huit médicaments biologiques qui traitent les maladies inflammatoires chroniques de l’intestin (MICI).
Ainsi, Miraca Life Sciences est le seul à proposer, aux États-Unis, le kit de monitoring de Inflectra® (Infliximab dybb), Cimzia® (Certolizumab pegol), Stelara® (Ustekinumab) et Simponi® (Golimumab). Miraca Life Sciences continue également d’offrir le kit de monitoring de Remicade® (Infliximab), Humira® (Adalimumab) et Entyvio® (Vedolizumab). Le rapport InformTxTM est unique car il fournit aux cliniciens à la fois des résultats de tests quantitatifs, des résultats de tests historiques et des conseils issus de la littérature scientifique la plus à jour et révisée par les experts. Le test mesure le niveau du médicament spécifié ainsi que les anticorps dérivés du patient pour ce médicament. Il utilise la technologie Elisa, validée en laboratoire pour les tests InformTxTM, et les résultats des tests sont rendus dans les cinq jours.
« De plus en plus de médicaments sont disponibles pour traiter les patients atteints de MICI, Miraca Life Sciences continuera ainsi à offrir des options de monitoring des biothérapies à nos collègues cliniciens », a déclaré Richard Lash, MD, Directeur Médical et Vice-président exécutif des opérations pour Miraca Life Sciences. « Suivre l’évolution des taux des médicaments et des anticorps anti médicaments présents chez un patient est essentiel afin d’offrir des soins optimaux. »
« Nous sommes satisfaits de l’extension de notre gamme qui est la plus large proposée aux États-Unis. Son développement est un des éléments clés pour poursuivre notre pénétration du marché américain et permettre la progression de nos ventes sur ce marché » ajoute Michel Finance, Directeur Général de Theradiag.
Création du prix IFCC » Gérard SIEST-Biologie Prospective Award »
A l’occasion de son congrès mondial triennal Worldlab, la Fédération Internationale de Biologie clinique et de Médecine de Laboratoire (IFCC) attribue plusieurs Prix « IFCC awards » à des personnalités scientifiques du monde de la biologie médicale ou à des cliniciens qui se sont distingués par une contribution exceptionnelle ou des travaux en biologie médicale et médecine de laboratoire qui ont amélioré la qualité et la pertinence des soins et de santé, et qui ont aussi permis à d’autres scientifiques d’avancer. Ces huit prix triennaux sont les plus grands honneurs que l’IFCC décerne à ses collègues du monde entier en reconnaissance de leurs recherches exceptionnelles.
Lors du dernier Worldlab à Durban, en octobre 2017, pour honorer la mémoire du Pr Gérard Siest, disparu en 2016, un neuvième « IFCC Award » a été créé à l’initiative de Jean-Pascal Siest, Président de Biologie Prospective et du Pr Howard Morris, ex-chair du IFCC Awards Committee et actuel Président de l’IFCC (2018–2020).
Le prix récompense un jeune biologiste médical, clinicien ou chercheur exceptionnel, âgé de moins de 40 ans à la clôture des candidatures, dont les travaux de recherche ont contribué à l’avancement de la pharmaco-génomique et de la médecine personnalisée. Les travaux peuvent porter sur la recherche fondamentale ou les applications en biologie médicale ou en clinique, ainsi que sur la normalisation, la gestion de la qualité, l’évaluation réglementaire ou l’utilisation thérapeutique.
Ce prix d’un montant de 10 000 euros sera remis pour la première fois à l’occasion du 24th International Congress of Clinical Chemistry and Laboratory Medicine (IFCC WorldLab Seoul 2020) au centre de congrès Coex à Séoul, en Corée (24–28 mai 2020).
Direction Générale de l’Inserm : Claire Giry remplace Thierry Damerval
Après 10 ans passés à la Direction Générale de l’Inserm, Thierry Damerval est nommé PDG de l’Agence Nationale de la Recherche (ANR) par décret présidentiel. Arrivé à l’Inserm en décembre 2007 en qualité de DG délégué à la stratégie, il est devenu DG délégué en 2011, aux côtés d’André Syrota puis d’Yves Lévy. En dix ans, il aura soutenu la stratégie de l’organisme au travers de grandes étapes de l’Inserm dans un contexte de transformation du paysage de la recherche : création de l’Alliance Aviesan, coordonnée par l’Inserm en 2009 ; évaluation de l’Inserm par un comité international en 2008 et 2015, définition des plans stratégiques 2010–2015, puis 2016–2020, et contrats d’objectifs et de performance associés ; participation de l’Inserm aux Programmes d’Investissement d’Avenir depuis 2010. Il a par ailleurs représenté l’Inserm dans de nombreuses instances essentielles au rayonnement de l’organisme, aux niveaux national, européen, ou international. Sur les grands sujets scientifiques, Thierry Damerval aura
appuyé la nouvelle structuration de l’Inserm en instituts thématiques qui a permis à l’organisme de répondre de manière réactive aux grands enjeux de recherche. Il a également accompagné la mise en œuvre des évolutions structurelles de l’établissement, en coordonnant depuis 2011 l’action des départements et des délégations régionales. Il a enfin veillé à renforcer le dialogue social, que ce soit dans le cadre du CHSCT dont il a assuré la présidence ou des interactions avec le CAES de l’Inserm. Le relais est maintenant passé à Claire Giry, qui était, depuis juillet 2016, responsable du programme « Centres d’excellence » du Commissariat général à l’investissement (CGI). Elle était précédemment Directrice adjointe de la recherche fondamentale du CEA et Directrice du centre de Fontenay-aux-Roses, centre de recherche principalement dédié aux sciences du vivant. Elle a occupé diverses fonctions relatives à la communication, aux affaires européennes et aux partenariats dans cet organisme. Elle a dirigé le Département des partenariats et relations extérieures de l’Inserm (partenariats nationaux, européens et internationaux) entre 2012 et 2014, et a auparavant mis en place le Service coordination stratégique et territoires du Ministère de l’enseignement supérieur et de la recherche, commun à la DGESIP et à la DGRI, notamment en charge des investissements d’avenir et des territoires. Entre 2007 et 2009, Claire Giry a été conseillère technique du Premier ministre, pour l’enseignement supérieur et la recherche. Née en 1970, ancienne élève de l’ENS de Lyon, elle est docteur en biologie moléculaire et cellulaire de l’Université Claude Bernard à Lyon et est chevalier de la Légion d’honneur et chevalier dans l’Ordre national du mérite.
Résistance aux antibiotiques : une nouvelle cible dans la paroi bactérienne
Depuis les années 40, les antibiotiques de type bêta-lactamines sont le traitement de choix pour de nombreuses infections. Elles perturbent la machinerie de formation de la paroi cellulaire en bloquant l’activité des Penicillin-Binding Proteins (PBPs), protéines qui catalysent les dernières étapes de la synthèse d’un de ses composants essentiels, le peptidoglycane. Ce « filet de pêcheur », qui entoure toute la bactérie, est essentiel non seulement à sa stabilité mais aussi au bon déroulement des différentes étapes du cycle cellulaire. C’est pourquoi plusieurs PBPs sont indispensables à la survie bactérienne. Outre leur fonction enzymatique, les PBPs sont engagées dans des interactions essentielles avec d’autres protéines qui participent à la formation de la paroi. L’une d’entre elles, MreC, est considérée comme une plateforme permettant la stabilisation d’autres protéines qui participent au même processus. Un complexe entre une PBP et MreC représenterait donc le « cœur »
de l’elongasome, structure clé pour la survie bactérienne qui pourrait être ciblée pour le développement de nouveaux agents antibactériens. Cependant, ces complexes ont toujours été considérés comme instables et fragiles, et leur étude structurale, très difficile. Des chercheurs ont pu caractériser, pour la première fois, le complexe PBP2:MreC du pathogène humain Helicobacter pylori. Cette structure cristalline obtenue à une résolution atomique grâce à la collecte de données au synchrotron ESRF à Grenoble, a révélé que pour réaliser leur interaction, PBP2 doit s’ouvrir, pour permettre la formation d’une structure qui ressemble à une fermeture éclair avec sa partenaire MreC. Cette structure reste fermée pour conserver l’association. Toute atteinte à l’ouverture de cette structure (mutations…) empêche non seulement la reconnaissance entre PBP2 et MreC mais aussi la bonne formation de la paroi lors de l’élongation des cellules filles, générant ainsi des cellules de diamètre aberrant qui éventuellement meurent. La superficie d’interaction entre les deux protéines pourrait être une cible potentielle pour le développement d’inhibiteurs totalement novateurs.
Un test sanguin pour prédire la récidive des cancers
Sur une cohorte de 100 patients de l’hôpital Saint-Louis, AP-HP, des chercheurs du CEA et de l’université Paris-Diderot, ont démontré que le taux de certaines cellules immunitaires dans le sang est prédictif de la récidive et de la progression tumorale dans le cancer de la vessie. Ils suggèrent d’utiliser le test sanguin breveté pour détecter la récidive d’autres types de cancers. La molécule HLA-G, pour Human Leukocyte Antigen, n’est normalement exprimée dans un organisme sain que pendant la grossesse, à la surface des cellules placentaires. Néanmoins, elle peut aussi s’exprimer dans certaines pathologies comme c’est le cas dans les organes transplantés ou à la surface des cellules tumorales.
Des premiers essais sur des greffes de cœur, réalisés en 2002 par Edgardo D. Carosella et son équipe du CEA à l’Hôpital Saint-Louis, et avec le professeur Alain Carpentier à l’hôpital Broussais, ont permis de constater que l’expression d’HLA-G produit une diminution significative du rejet aigu et une absence de rejet chronique. En outre, l’expression de cette molécule dans les tumeurs est corrélée à un mauvais diagnostic. En effet, si une tumeur n’est pas reconnue par le système immunitaire, elle n’est pas détruite. Les cellules cancéreuses utilisent HLA-G pour se protéger des défenses immunitaires de l’hôte, et ainsi se développer et récidiver. L’expression d’HLA-G est associée à l’évolution de la maladie, les risques de récidive et d’extension sont alors liés à celle-ci. Face au cancer, HLA-G agit comme un bouclier et inhibe l’ensemble de la réponse immunitaire.
Afin d’anticiper l’évolution des tumeurs et d’amoindrir les risques de récidive, les professeurs Carosella et Desgrandchamps ont analysé l’expression d’HLA-G dans les tumeurs de vessie en cherchant à comprendre comment le système immunitaire pouvait être mis en défaut et laisser se développer la tumeur. Il s’agit d’une réelle avancée clinique puisque les cancers de la vessie sont fréquents, avec un composant immunologique important sans pour autant bénéficier d’un traitement efficace.
Il se trouve que les lymphocytes du sang périphérique chargés de la destruction des cellules cancéreuses, les lymphocytes cytotoxiques CD8, expriment à leur surface un récepteur, appelé ILT2, dont l’activation bloque ces cellules CD8. L’étude de prélèvements sanguins de plus de 100 patients atteints d’un cancer de la vessie et suivis pendant trois ans a permis de démontrer que la récidive des tumeurs de vessie dépend du pourcentage des cellules CD8+ ILT2+ circulant dans le sang. Lorsque les patients ont une tumeur qui récidive, plus de 40 % de ces lymphocytes CD8 portent ce récepteur. Cela signifie que le système immunitaire du patient est affaibli vis-à-vis de la tumeur et peut facilement être inhibé. Le taux de CD8+ ilt2+ permet alors de différencier les patients qui ont un risque accru de récidiver. Les chercheurs considèrent, à partir d’analyses biostatistiques sur des cohortes de patients, qu’en dessous de 20 %, le risque de récidive est faible et qu’au-dessus de 40 % le risque est important.
Une demande de brevet a été déposée par les équipes en vue du développement d’un kit d’évaluation. Cette technologie développée à l’hôpital Saint Louis, AP-HP, a été lauréate des Trophées APinnov 2017. Ce test gagnerait à être évalué à grande échelle et sur d’autres types de tumeurs, à l’aide du kit développé par les professeurs Carosella et Desgrandchamps. Ce serait une solution simple et non invasive pour la plupart des hôpitaux et laboratoires privés, puisqu’il s’agit, à partir d’une simple prise de sang, d’une technique classique de cytométrie en flux applicable dans de nombreux endroits.
 |
Egalement dans Spectra Biologie n° 232 |
-
-
-
BOURSE & BIOTECHS
Rachat et essais cliniques aux commandes
Arsia AMIR-ASLANI, Arnaud VELY, Nicolas YAGHAIAN -
UN POINT SUR
Validation et communication des résultats
Alain CŒUR -
RÉGLEMENTATION
Règlement général européen sur la protection des données (RGPD) à caractère personnel
Partie 1 : Origine, objectifs et implications
Marguerite BRAC DE LA PERRIERE
-
RÉGLEMENTATION
Règlement général européen sur la protection des données (RGPD) à caractère personnel
Partie 2 : Mise en œuvre dans les laboratoires de biologie médicale
Bruno GAUTHIER -
TECHNOLOGIE APPLIQUÉE
Les systèmes d’information pour laboratoires de biologie médicale en 2017
Alain CŒUR
-
-
La Newsletter Spectra Biologie est une publication des Editions PCI
176, rue du Temple – 75003 Paris
Tél. : 01 44 59 38 38
www.spectrabiologie.fr – pci@pcipresse.com